هیدروکسید سدیم یک جامدخورنده و محلول درآب است. رایج ترین روش تهـیه NaOH،الکترولیز محلول آب نمک می باشد.
مواد را می توان بر اساس خواص مختلف شان به اسید، باز و نمک طبقه بندی کرد. اما سؤالی که مطرح شده آن است که آیا سدیم هیدروکسـید یک اسید است یاباز؟دراین مقالــه به بررسی نظریه های مختلف در اسیدها و بازها و بررسی دقیق ماهیت هیدروکسید سدیم می پردازیم .
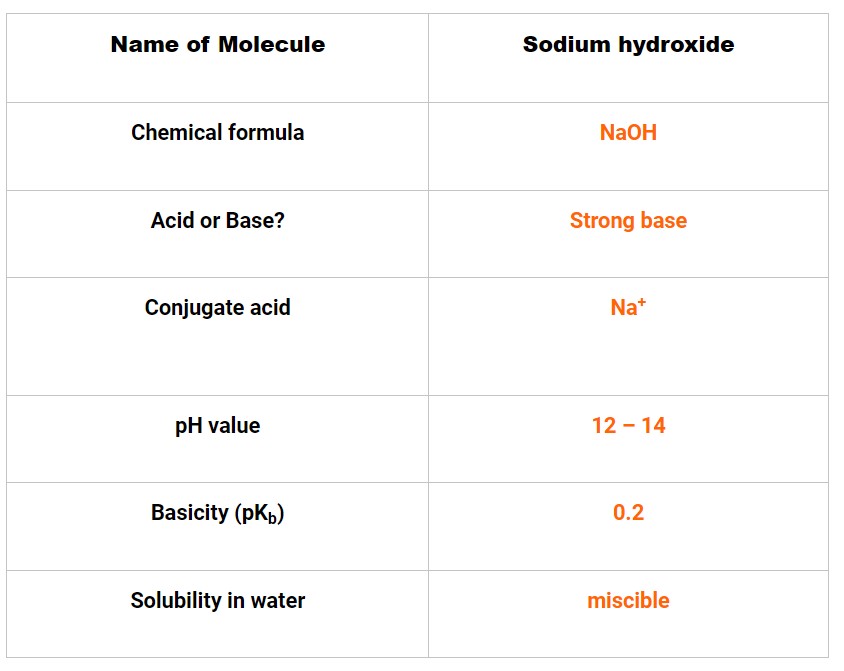
سدیـم هیدروکسـید شامل یک یون سدیم با بار مثبت و یک یون هیدروکســیل با بار منفــی است.
یک الکترون از پوسته خارجی سدیم به طور کامل به سمت اکسیژن موجود در مولکول هیدروکسیل منتقل می شود.
بار مثبت سدیم به دلیل تعداد پروتون ها از الکترون ها بیشتر است. اکسیژن در گروه هیدروکسیل با دریافت یک الکترون به لایه ظرفیتی خود بار منفی پیدا می کند و بار کل ساختار هیدروکسید سدیم را صفر می کند.
از آنجایی که برهمکنش یونی بین Na+ و OH- فقط یک جاذبه الکتریکی است، هیچ رابطه فیزیکی بین آنها وجود ندارد.
از نظر تئوری، سه نظریه نظریه وجود دارد که آیا NaOH باز است یا اسید.
۱) نظریه آرنیوس
۲) نظریه برونستد-لوری
۳) نظریه لوئیس
بر اساس تئوری آرنیوس، زمانی که سدیم هیدروکسید از طریق یونیزاسیون یا از طریق تفکیک در آب، یون های OH- تولید می کند غلظت یون های OH- را در یک محلول آبی افزایش می یابد که به آن پایه گفته می شود.
واضح است که وقتی NaOH در یک محلول آبی حل میشود، یونهای OH- تولید میکند، بنابراین، NaOH یک باز آرنیوس است.
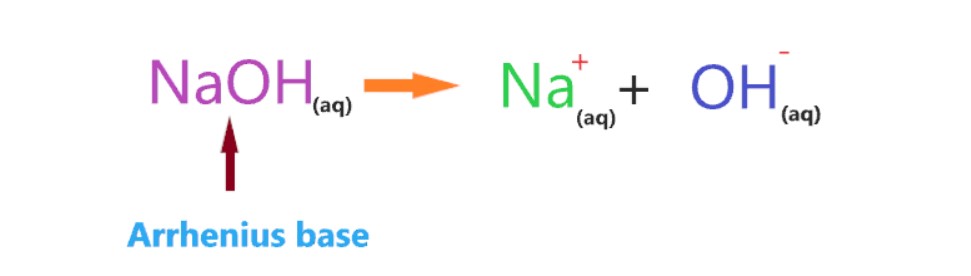
بـر اساس این نظریه، ماده ای که یک پروتون از دست می دهد اسید است، در حالی که ماده ای که پروتون به دست می آورد، باز نامیده می شود.
وقتی NaOH با یک اسیــد واکنش می دهد، NaOH و OH- پروتون از دست رفته توسط اسید را می پذیرند و مانند یک باز برونــستد-لــوری عمل می کند. بنابراین، در یون های هیدروکسید، غلظت بالا تر به معنای پایه قوی تر است.
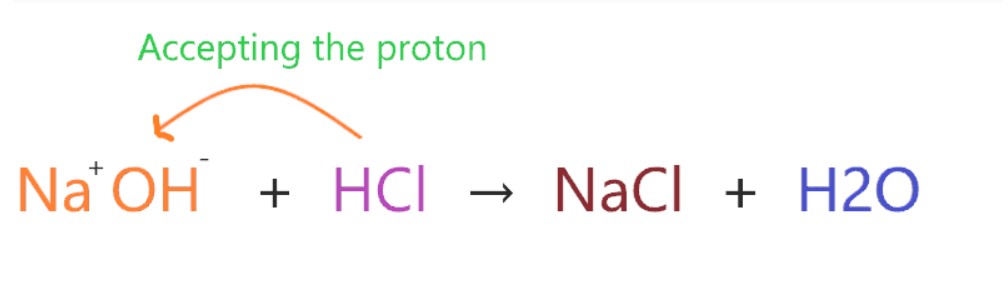
بر اساس این نظــریه، ماده ای که یک جفت الکترون به دست می آورد، اسید لوئیس است، در حالی که ماده ای که یک جفت الکترون از دست می دهد، باز لوئیس نامیده می شود. اسیدهای لــوئیس ترکیبات دارای کمبود الکترون هستند.
اسید لوئیس ← گیرنده جفت الکترون
پایه لوئیس ← اهدا کننده جفت الکترون
از آنجایی که NaOH حاوی یون OH- است، دارای سه جفت تک الکترون دارد و به راحتی می تواند این جفت الکترون ها را برای تشکیل به یک پیوند کووالانسی با گیرنده ترکیب دیگر ببخشد.
بنابراین، می توان گفت NaOH نیز پایه لویس است.
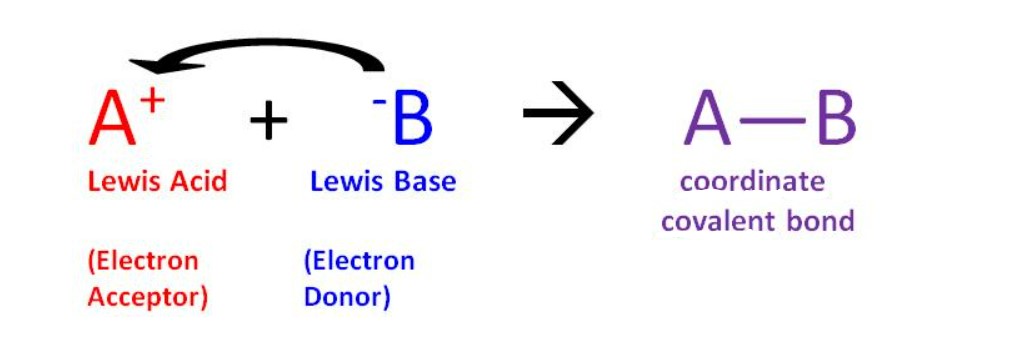
بــنابراین ، طبق هر سه نظریه اصلی
NaOH به عنوان پایه طبقه بندی شده است.
همه پایه ها در آب محلول نیستند. به بازهایی که در آب محلول هستند قلیایی می گویند. هیدروکسید سدیم یک قلیایی است.اما "آیا سدیم هیدروکسید یک باز ضعیف است یا قوی؟ "خواندن این مقاله را به شما دوست عزیز توصیه می کنیم.