هیدروکسید سدیم (NaOH) از یون هــای سدیم و هیدروکسید تشکیل شده است.از ســــدیم هیدروکسیدبه عنوان یک پایه شیمیـــایی قوی در تولید محصولاتی مانند خمیر و کاغذ ،منسوجات، آب آشامیدنی و مواد شوینده استفاده می شود. برای اینکه بدانید هیدروکسید سدیم (NaOH) یک باز قوی است یا یک باز ضعیف،باید تفاوت اساسی بین یک باز قوی یا یک باز ضعیف را بررسی کنید.
باز ضعیف در یک محلول آبی به طور کامل تجزیه نمی شود تا مقدار زیادی یون OH- تولید کند.
در حالت تعادل در محلول، هم باز تفکیک نشده و هم محصول یونیزه شده وجود دارد.
بــازقوی در یک محلول آبــی به طور کامل تجزیه شده و تعداد زیادی یون هیــدروکسید آزاد می کند. تمام مول های باز تجزیه می شوند تا یون هیدروکسید (OH-) تولید شود. در نتیجه هیچ باز تفکیک نشده ای در محلول باقی وجود ندارد.

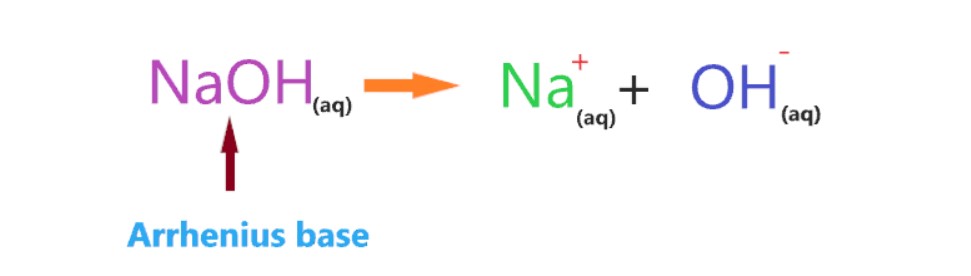
در یک محلول آبی،NaOH به یونهای سدیم (Na+) و یونهای هیدروکسید (OH-)تجزیه میشود.
باز بودن قوی NaOH به این دلیل است که تقریباً همه مولکول های NaOH تجزیه می شوندوتعداد زیادی یون هیدروکسید را آزاد می کند.یونهای- OH به آسانی پروتونها (یون H+ )را از مواد اسیدی میپذیرند که منجر به واکنشهای خنثـــیسازی و تشکـــیل آب و نمک میشود.
هنگامی که NaOH در آب حل می شود،به طور کامل به یون ها (Na+ و OH–)یونیزه می شود.هیچ مولکولی تفکیک نشده (NaOH) در محلول وجود ندارد،فقط یون های یونیزه شده در همه جای محلول وجود دارد.
فلش منفرد استفاده شده در واکنش زیرنشان می دهد که فقط یک واکنش رو به جلو رخ می دهد،به این معنی که وقتی مولکول NaOH یونیزه شده شکسته می شود دیگر قابلیت برگشت به حالت اولیه خود را ندارند.
از آنجایی که Na+ اسیدمزدوج بسیـــار ضعیف NaOH است،بنابراین توانایی واکنش با یون OH- و یا با یونهای مولکولهای آب را ندارد. بنابراین، تنها یون های شکافنده (Na+ و OH–)در محلول باقی می مانند.
در نتیجه،NaOH به دلیل غلظت بالای یونهای هیـــدروکسید،یک بازقوی در محلولهای آبی درنظر گرفته میشود و آن رابه یک معرف ضروری در فرآیندهای مختلف شیمیایی وکاربردهای آزمایشگاهی تبدیل میکند.
هنگامی که سدیم هیدروکسید در آب حل می شود، باعث شکسته شدن سود به یون های سدیم مثبت و هیدروکسید منفیمی شود.ما وقتی این یون ها توسط مولکول های آب احاطه می شوند، مقدار زیادی انرژی تولید می کنند. مقدار انرژی که از این هیدراته شدن حاصل می شود بسیار زیاد بوده و در کل واکنش گرماده می شود.
با توجـــه به جدول پایین،هنگامی که هیدروکســید سدیم به عنوان یک باز قوی ، در آب تجــزیه می شود ،یــون های هیدروکسید (OH-) در محلول از غلظت بالایی برخوردار است.در نتیجه محلول بسـیار قلیایی با pH بیشتر از ۷ در محلول است و واکنش پذیری قوی با اسیدها را نشان می دهد.
از طرفی، هنگامی که یک باز ضعیف در آب دچار تفکیک جزئی شود. یون های هیدروکسید در محلول از غلظت کمتری برخودار می شود.در نتیجه، محلول فقط کمی قلیایی است و pH آن بیشتر از ۷ (اما نزدیک به ۷) است.
بازهای ضعیف رسانایی الکتـریکی کمتری نسبت به بازهای قوی دارند و با اسیدها کندتر و ملایم تر واکنش میدهند.
برای بررسی بهتر ، نمونه ای از یک باز ضعیف NH۴OH (هیدروکسید آمــونیوم) در جدول نشان داده شده است. لازم به ذکر است که پایه های ضعیف اغلب در کـــاربردهای مختلف از جمله محصولات پاک کننده خانگی و دارویی استفاده می شود که در آن پایه ملایم تر و کنترل شده مطلوب است.
.jpg)